6.6.1.2. iPSC体外分化制备心肌细胞Cardiomyocytes
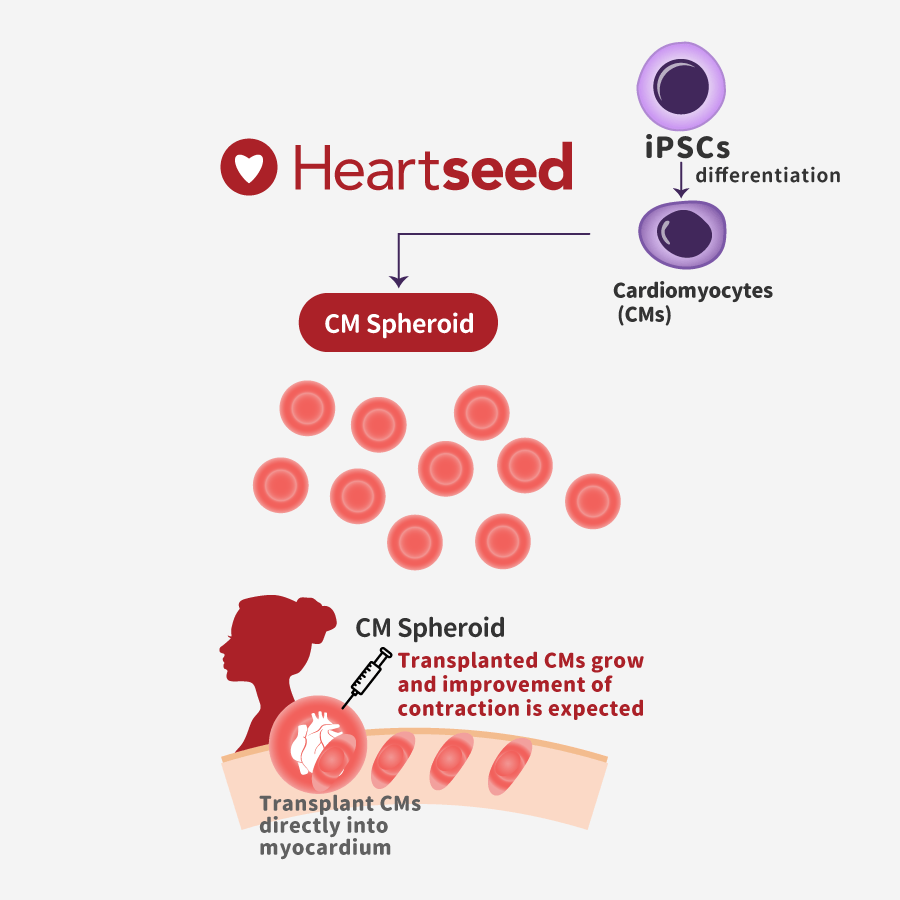
策略:心血管疾病是导致死亡的主要原因,而心力衰竭伴左心室射血分数(LVEF)降低是其中主要疾病。移植足够数量的心室心肌细胞是治疗心力衰竭伴左心室射血分数降低Heart Failure with Reduced Ejection Fraction (HFrEF)的最佳可能方法。
目标适应症:目标适应症是HFrEF,包括扩张性心肌病(DCM)、老年心肌分数(OMI)和肥厚性心肌病(D-HCM)
产品:异体iPSC源心肌细胞
给药途径:心肌内注射
无免疫排斥产品:自体iPSC或HLA敲除的iPSC
(摘自https://heartseed.jp/en/#pipeline)
泉生公司临床前试验工作
1. 泉生iPSC扩增培养体系
依托现有的商品化试剂,通过极为成熟的培养方法,团队成员充分掌握了iPS快速扩增实验方法。细胞可实现指数级扩增,单位iPS经过15天培养可实现200万倍以上扩增(图1)
图1. 单位iPS扩增曲线(泉生临床前试验数据;商业秘密)

扩增的iPS维持稳定的多能干细胞特异标志,如高水平表达碱性磷酸酶(图2)、表达OCT4、NANOG、SOX2和LIN28A基因(图3)、高水平表达NANOG和OCT4蛋白标志(图4)。
图2. iPS碱性磷酸酶染色(泉生临床前试验数据;商业秘密)

**************************************************************************
图3. RT-PCR检测iPS细胞表达OCT4、NANOG、SOX2和LIN28A基因(泉生临床前试验数据;商业秘密)

**************************************************************************
图4. 细胞免疫荧光检测iPS表达NANOG和OCT4蛋白(泉生临床前试验数据;商业秘密)

同时,扩增的iPS保持较高的细胞纯度。通过流式细胞术检测显示iPS细胞纯度高达99.8%(图5)。图5流式细胞术检测iPS多能性标志物OCT4的表达率。
图5. 流式细胞术检测iPS多能性标志物OCT4的表达率(泉生临床前试验数据;商业秘密)

2. 泉生iPSC定向分化心肌细胞 allogeneic iPSC-derived cardiomyocytes
经验证,扩增的iPS保持良好的分化潜能,通过添加特定的培养基,可诱导iPS分化为搏动的心肌细胞(CM)(图6)。RT-PCR检测iPS分化的细胞表达心肌细胞特异性结构蛋白TNNT2和TNNI3,心房样心肌细胞特异性结构蛋白MYL7,心室样心肌细胞特异性结构蛋白MYL2(图7)。细胞免疫荧光鉴定iPS分化的细胞表达心肌特异性结构蛋白cTNT和ɑ actinin(图8)。此外,iPS分化的心肌细胞纯度高达96.79%(图9)。
图6. iPS分化为心肌细胞流程图

**************************************************************************
图7. RT-PCR检测iPS-CM功能性基因的表达(泉生临床前试验数据;商业秘密)

**************************************************************************
图8. 细胞免疫荧光检测iPS分化的心肌细胞特异蛋白的表达(泉生临床前试验数据;商业秘密)

**************************************************************************
图9. 流式细胞术检测hiPS-CM分化效率(泉生临床前试验数据;商业秘密)

通过添加特定的培养基,可诱导iPS分化为肝细胞(HLC),iPS来源的iPS-HLC呈现鹅卵石状排列,细胞形态饱满,连接紧密(图10)。RT-PCR检测iPS分化的细胞表达肝细胞特异基因AFP、ALB、A1AT、HNF4A、CYP3A4,其中AFP表达量较低,其他成熟标志基因表达量高,说明肝细胞达到成熟状态(图11)。细胞免疫荧光鉴定iPS分化的细胞表达肝细胞特异性结构蛋白Albumin和α-1 Antitrypsin蛋白(图12)。同时,iPS分化的肝细胞具有较强的糖原储存能力(图13)以及肝功能(图14)。
图10. iPS源肝细胞形态图(泉生临床前试验数据;商业秘密)

**************************************************************************
图11. RT-PCR检测iPS- HLC功能性基因的表达(泉生临床前试验数据;商业秘密)

**************************************************************************
图12. 细胞免疫荧光检测iPS分化的肝细胞特异蛋白的表达(泉生临床前试验数据;商业秘密)

**************************************************************************
图13. PAS检测iPS- HLC糖原储存(泉生临床前试验数据;商业秘密)

**************************************************************************
图14. 吲哚菁绿检测iPS- HLC肝细胞功能(泉生临床前试验数据;商业秘密)

3. iPS定向分化自然杀伤细胞(NK)
依托现有技术,结合相关文献,采用分阶段法诱导iPS分化制备NK细胞。第一阶段诱导iPS形成EB,进行悬浮培养,第二阶段对EB进行贴壁培养,实现iPS-NK细胞制备(图15)。
图15. iPS定向分化NK示意图

现阶段已对不同密度iPS细胞诱导形成EB展开实验,分别对500、1000、1500、2000、3000和4000个iPS细胞形成EB大小进行对比(图16)。
图16. 不同iPS细胞密度形成EB大小(d6)(泉生临床前试验数据;商业秘密)

现正处于推进筛选的合适的iPS形成的EB实施贴壁培养阶段。
未来将结合先进的多能干细胞悬浮培养体系,进行生物反应器悬浮培养快速扩增iPS[21, 22](图17),进一步标准化制备大小合适的EB(图18),实现流程化、标准化、规模化生产制备EB,从而大规模生产iPS源NK细胞。
图17. 悬浮培养罐[21](泉生临床前试验数据;商业秘密)

**************************************************************************
图18. 悬浮培养的大小一致的细胞团[21](泉生临床前试验数据;商业秘密)

2.4 CAR-NK安全性评价
现已建立iPS源心肌细胞的体外安全性评价体系,可用于肿瘤药物及新型疗法的安全性评价。
以传统抗癌化疗药物阿霉素(doxorubicin, DOX)为例,证明了DOX可引起心肌细胞的损伤及死亡,具有一定心肌毒性(图19)。
图19. DOX体外诱导的心肌损伤及死亡

DOX剂量依赖性诱导iPS源心肌细胞的死亡。DOX处理后,部分心肌细胞死亡漂浮,证明DOX具有一定心肌毒性(图20)。
图20. DOX诱导iPS源心肌细胞死亡(泉生临床前试验数据;商业秘密)

DOX剂量依赖性诱导iPS源心肌细胞LDH释放水平的增高(图21)。LDH为乳酸脱氢酶,在临床上作为心肌损伤的标志物之一。
图21. DOX诱导iPS源心肌细胞LDH释放水平增高(泉生临床前试验数据;商业秘密)

临床数据显示,CAR-T细胞治疗副作用包括心脏毒性不可忽视,包括各种心律失常、短暂性左心室功能不全和肌钙蛋白升高,这些都会导致更严重的后果,如心源性休克、猝死等[23, 24]。CAR-NK细胞较T细胞有明显的优势,免疫原性更低。目前建立的iPS源心肌细胞和肝细胞模型为CAR-NK安全性评价提供有效体外评价模型。
参考文献
1. Sugita, S., et al., Natural Killer Cell Inhibition by HLA-E Molecules on Induced Pluripotent Stem Cell-Derived Retinal Pigment Epithelial Cells. Invest Ophthalmol Vis Sci, 2018. 59(5): p. 1719-1731.
2. Martinet, L. and M.J. Smyth, Balancing natural killer cell activation through paired receptors. Nature Reviews Immunology, 2015. 15(4): p. 243-254.
3. O'Brien, K.L. and D.K. Finlay, Immunometabolism and natural killer cell responses. Nat Rev Immunol, 2019. 19(5): p. 282-290.
4. 陈锦 and 张彩, 嵌合抗原受体修饰的免疫细胞及其在肿瘤免疫治疗中的应用. 中国肿瘤生物治疗杂志, 2021. 28(06): p. 549-557.
5. Zeng, J., et al., Generation of "Off-the-Shelf" Natural Killer Cells from Peripheral Blood Cell-Derived Induced Pluripotent Stem Cells. Stem Cell Reports, 2017. 9(6): p. 1796-1812.
6. Matsubara, H., et al., Induction of human pluripotent stem cell-derived natural killer cells for immunotherapy under chemically defined conditions. Biochem Biophys Res Commun, 2019. 515(1): p. 1-8.
7. 唐甜 and 饶巍, 自然杀伤细胞抗肿瘤免疫治疗研究进展——从实验室到临床. 中国肿瘤, 2017. 26(01): p. 44-52.
8. Lee, B.J. and E.M. Mace, Acquisition of cell migration defines NK cell differentiation from hematopoietic stem cell precursors. Mol Biol Cell, 2017. 28(25): p. 3573-3581.
9. Huang, G.P., et al., Ex vivo expansion and transplantation of hematopoietic stem/progenitor cells supported by mesenchymal stem cells from human umbilical cord blood. Cell Transplant, 2007. 16(6): p. 579-85.
10. Karagiannis, P., et al., Induced Pluripotent Stem Cells and Their Use in Human Models of Disease and Development. Physiological Reviews, 2019. 99(1): p. 79-114.
11. Karagiannis, P. and S.I. Kim, iPSC-Derived Natural Killer Cells for Cancer Immunotherapy. Molecules and Cells, 2021. 44(8): p. 541-548.
12. Yamanaka, S., Pluripotent Stem Cell-Based Cell Therapy-Promise and Challenges. Cell Stem Cell, 2020. 27(4): p. 523-531.
13. Takahashi, et al., Autologous Induced Stem-Cell-Derived Retinal Cells for Macular Degeneration Reply. New England Journal of Medicine, 2017.
14. Knorr D.A., N.Z., Hermanson D., Hexum M.K., Bendzick L., Cooper L.J., Lee D.A., Kaufman D.S., Clinical-Scale Derivation of Natural Killer Cells From Human Pluripotent Stem Cells for Cancer Therapy. Stem Cells Transl Med, 2013. 2(4).
15. Imai C., I.S., Campana D., Genetic modification of primary natural killer cells overcomes inhibitory signals and induces specific killing of leukemic cells. Blood, 2005. 106: p. 8.
16. Xie G., D.H., Liang Y., Ham J.D., Rizwan R., Chen J., CAR-NK cells: a promising cellular immunotherapy for cancer. EBioMedicine, 2020. 59: p. 10.
17. Oei V, S.M., Graczyk-Jarzynka A. , Intrinsic Functional Potential of NK-Cell subsets constrains retargeting driven by chimeric antigen receptors. Cancer Immunol Res, 2018. 6(4): p. 14.
18. Sun, C., et al., NK cell receptor imbalance and NK cell dysfunction in HBV infection and hepatocellular carcinoma. Cellular & Molecular Immunology, 2015. 12(3): p. 292.
19. Cheng, S., et al., Natural killer cell dysfunction in hepatocellular carcinoma and NK cell-based immunotherapy. Acta Pharmacologica Sinica, 2015. 36(10): p. 1191-1199.
20. Karagiannis P, K.S.I., iPSC-Derived Natural Killer Cells for Cancer Immunotherapy. Molecules and Cells, 2021. 44(8): p. 8.
21. Breanna S. Borys, T.S., James Colter,Tiffany Dang,Erin L. Roberts,Tamas Revay,Leila Larijani,Roman Krawetz,Ian Lewis,Bob Argiropoulos,Derrick E. Rancourt,Sunghoon Jung,Yas Hashimura,Brian Lee,Michael S. Kallos, Optimized serial expansion of human induced pluripotent stem cells using low-density inoculation to generate clinically relevant quantities in vertical-wheel bioreactors. STEM CELLS Translational Medicine, 2020. 9(9): p. 17.
22. 香川英章, 后., 小桥创一,中辻宪夫,饗庭一博, 多能干细胞的传代方法[P]. 日本:CN109153972A,2019-01-04.
23. Ahmed, T., Cardiovascular Risk Profile of Chimeric Antigen Receptor T-cell Therapy. Cureus, 2020. 12(3): p. e7436.
24. Ghosh, A.K., et al., CAR T Cell Therapy-Related Cardiovascular Outcomes and Management Systemic Disease or Direct Cardiotoxicity? Jacc: Cardiooncology, 2020. 2(1): p. 98-109.